A-Level化学篇:Mass spectrometry质谱分析法
阅读量:
大家都知道化学是一门以实验为基础的学科,今天就以质谱分析法(mass spectrometry)为例,来讲一讲仪器分析方法是如何做到将抽象的名词具象化,来帮助我们理解和掌握这些概念的。
Mass spectrometry在AS的Topic 2-2A当中第1次出现。在这一章之前,我们介绍了相对原子质量(relative atomic mass)与相对同位素质量(relative isotopic mass)的区别。正是因为大多数元素都拥有不止一种同位素(isotope),才使得同一种物质的微粒可能由质量上有些微差别的同位素原子组成,具有不同的相对式量(relative formula mass)。但是也由于各种同位素原子在自然环境中的含量占比,即丰度(abundance)是相对恒定的,所以这些物质的相对式量得以用一个均值来表示。
质谱分析法是一种非常重要的仪器分析手段,采用质谱仪(mass spectrometer)测量原子与分子质量,也可以用来辨别不同的同位素。质谱仪的内部结构如下图所示:
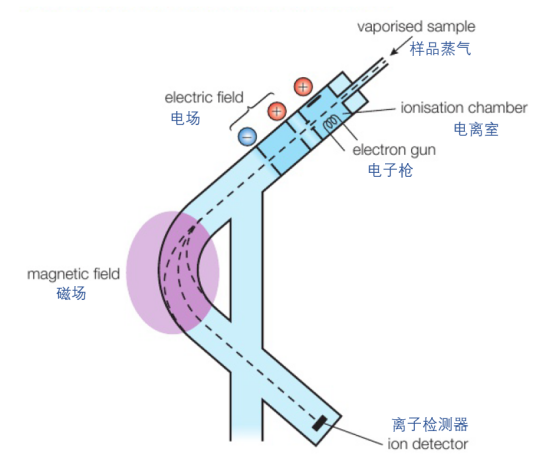
它的工作流程可以视为:
①电离(ionisation):首先,需要将待测样以气态形式(gaseous state)注入质谱仪。接下来,样品蒸气在高能电子的轰击下,一些电子会受到撞击而脱离,形成带正电荷的微粒(positive ions)。
②加速(acceleration): 带正电的微粒经过一段电场,将会被加速。
③偏转(deflection): 再经过一段磁场后,微粒的运行轨迹会因为各自的质荷比(mass-to-charge, m/z)不同而发生不同程度的偏转。质荷比越大,偏转程度越小。
④检测(detection):偏转后的粒子将通过一个狭缝,落在一个与放大器连接的金属平面上被收集检测。通过产生的电流大小,反映出收集到的微粒所占比重。
⑤分析(analysis):由于磁场的强度可以调节,我们将收集到不同质荷比的粒子,最后将得到的数据绘制成图像,来分析样品的组成与质量。
接下来,我们以氯气进样微粒来看一下图像如何分析:
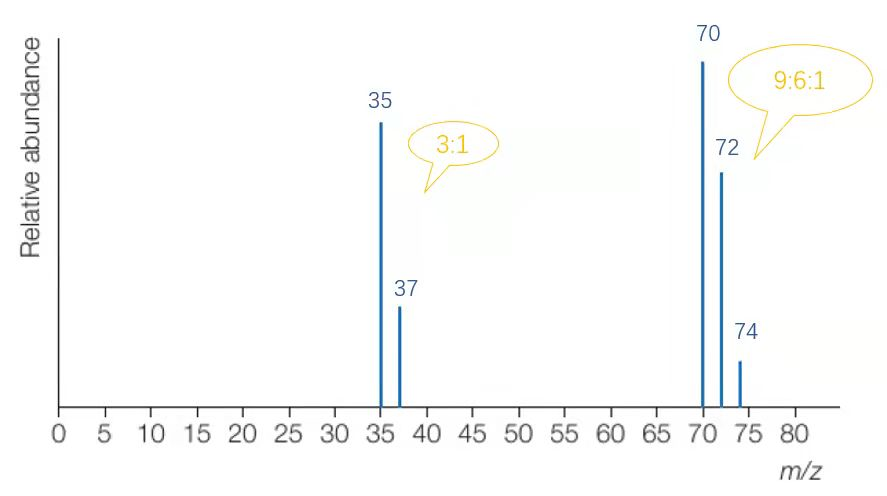
在将相对式量保留到整数位后,可以得到上图。
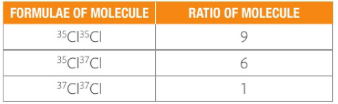
横坐标为质荷比(m/z),在假定电荷数z=1的状况下,横坐标可以视为相对质量;而峰(peak)的高度表示了该粒子的占比,对于原子来说,也即丰度。结合已有的同位素知识,我们知道氯原子有Cl-35与Cl-37两种同位素,其相对含量的比值约为3:1,恰与此图相符。质谱分析法的图像将这一抽象概念直观地展示了出来。
假设共有100个氯原子,则根据Cl-35与Cl-37的丰度约为3/4和1/4,其中的Cl-35原子有75个,Cl-37原子有25个,所有Cl原子的平均式量为图片,正是我们熟悉的标在元素周期表上的Cl的相对同位素质量。
而70,72,74这三个峰则代表着三种不同式量的氯气。

这三种氯气分子的占比又怎么求呢?由于 Cl-35占3/4,Cl-37占1/4,任取两个Cl原子组成氯气分子Cl2,35Cl35Cl的概率为:图片
35Cl37Cl的概率为: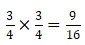
(注意这里×2的原因是同样要计算37Cl35Cl的概率)
37Cl37Cl的概率为: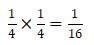
所以最后我们得到这三种氯气的比值是9:6:1,和图像上标出的各峰高度也能保持基本一致。(由于相对式量不是精确值,故图上各峰高度之比也不是精确的9:6:1)
而氯气的平均相对式量不管是由氯原子的relative isotopic mass来算:35.2×2=71,或者是由三种氯气的组成和质量来算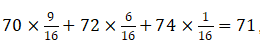 都能得到相同的答案71。
都能得到相同的答案71。
同学们以后遇到mass spectrometry的问题都可以用类似的模型来解答。
